地下水中金属的迁移性
地下水中金属和类金属(本文统称为“金属”)的迁移性是评估这些污染物构成的风险及其修复措施的基础。可迁移污染物比不可迁移污染物更有可能以超过风险水平的浓度到达环境受体。地球化学梯度(如污染羽中pH值的变化、氧化还原电位、离子强度随时间和空间的变化)导致污染物通过吸附和/或沉淀分离到含水层固体。这种分配控制了地下水中金属污染物的迁移性。

▲ 概念模型
介 绍
污染物的迁移性是指污染物相对于地下水迁移的速率。高迁移性的污染物以接近地下水的速度迁移,并在与地下水相同的时间范围内从源头到达受体。其他污染物受到地球化学反应的影响,导致它们分离到含水层固体。这种分离造成污染物相对于地下水的迁移延迟。阻滞的程度取决于污染物的化学性质、地下水的化学成分、含水层的矿物组成。在一组含水层条件下具有高度迁移性的污染物在不同条件下可能相对不具有迁移性。
水形态反应、吸附、沉淀控制了金属向含水层固体的分离,从而控制了它们的迁移性。吸附和沉淀导致污染物向含水层固体分离,水形态反应对吸附和沉淀发生的程度有很大影响。这些过程可以被认为是化学反应,其中成分在平衡常数决定的程度上反应形成产物。在大多数水地球化学教科书中都可以找到关于吸附、沉淀、水形态反应的讨论,其他参考文献也讨论了这些如何应用于特定金属。
研究导致水形态、吸附、沉淀的反应需要简要讨论平衡常数和活性。任何反应有:
wA + xB = yC + zD
其中w、x、y、z是反应的化学计量系数,A、B、C、D是化学物质,平衡常数决定了反应是向右、向左、还是根本不进行。重要的指标是这个比率:

式中 ai 为物质i的活性(有效浓度;热力学活性)。当该比值小于平衡常数时,反应倾向于向左进行,反之亦然。如果比值等于平衡常数,则反应处于平衡状态,不会朝任何一个方向进行。大多数大学水平的化学入门教科书都会对平衡常数和活性进行完整的讨论。

▲ 4<pH<9时污染物迁移性总结
水形态
金属和类金属的单一或自由溶解离子可以与其他溶解离子结合,形成不同的溶解种类,称为水络合物,其化学性质与原始离子不同。金属污染物与地下水中相对丰富的离子形成水络合物。例如,溶解的汞离子Hg+2 在弱酸性条件下很容易与氯离子结合,反应如下:
Hg+2 + 2Cl- = HgCl2o (其中 HgCl2o 是溶解物质)
这个反应有一个结合常数或平衡常数,它决定了溶液中Hg+2、Cl- 和HgCl2o 在平衡状态下的比例。汞可以形成许多其他的水络合物,它在这些水络合物中的分布被称为汞的水形态。此外,随着地下水条件的变化,水形态也会发生变化。例如,研究在Eh-pH图上计算出的铀的水形态(图1)。在不同的pH和Eh值下,主要种类是不同的(沿着种类主导区之间的红线,种类活性是相等的)。Eh是衡量电子从一个离子流向另一个离子的趋势,而pH是地下水酸性或碱性的指标。当参与形态反应的其他组分具有不同的活性(例如钙和与系统平衡的CO2逸出度)时,水形态也不同。

▲ 图1. 铀的水形态,PCO2=0.01大气压。,[Ca]=10 mg/L
由于不同种类的金属被含水层矿物吸附的程度不同,所以形态会影响金属的吸附。这是因为含水物质的电荷半径和水合半径不同,这些性质对吸附有重要影响。水形态影响沉淀,因为矿物的溶解度是由单个种类矿物决定的。例如,如果矿物铅矾的溶解度由Pb+2离子定义,而Pb+2只是铅水形态中的一个次要形态,那么实际溶解度将高于由“关系式”计算出的溶解度:
Ksp = aPb+2 X aSO4-2
其中Ksp是溶解度积常数,或固体物质在水溶液中溶解的平衡常数,而a是反应中每一种不同种物质的活性或有效浓度。
氧化还原化学在某些金属(如砷(as)、铬(Cr)、铜(Cu)、汞(Hg)、硒(Se)、铀(U))的水形态中起着重要作用。在受污染的地下水中发现的条件范围内,这些污染物可以以多种氧化状态存在。氧化态的变化可以深刻地改变金属或类金属的吸附行为和溶解度。改变金属氧化态的反应通常受到动力学限制,但可以通过微生物相互作用催化。因此,对于对氧化还原电位敏感的金属,在评估迁移性时考虑微生物活性和与污染物的潜在相互作用是很重要的。
吸附
**吸附可以定义为将一种成分作为二维“涂层”分配到含水层固相表面。对于携带电荷的水性物质,分配是由静电吸引驱动的,然后是组成部分与固体表面的潜在键合。不带电的(中性)物质可能被吸附在含水层固体表面,因为它们被水分子相互间更有利的能量吸引所排斥,被赶出水相。大多数含水层矿物的表面都带着随pH值变化的电荷。对于氧化物和硅酸盐来说,电荷主要是表面部分结合的氧原子的结果。产生的负电荷吸引带正电荷的离子。能与表面氧结合的最常见、能量上最有利的离子之一是氢离子。因此,随着地下水pH值的降低和氢离子的丰富,更多的氢离子接近表面氧,中和了负电荷(图2)。所有电荷被中和的pH值称为电荷零点(ZPC)。当pH值低于ZPC时,矿物表面带正电。含水层矿物的这种变化的表面电荷行为是控制金属和类金属污染物吸附的重要因素。那些主要以阳离子形式存在于地下水中的污染物随着pH值的增加而被吸附得更强。当pH值降低时,那些主要以阴离子形式存在的离子往往吸附得更强。
**
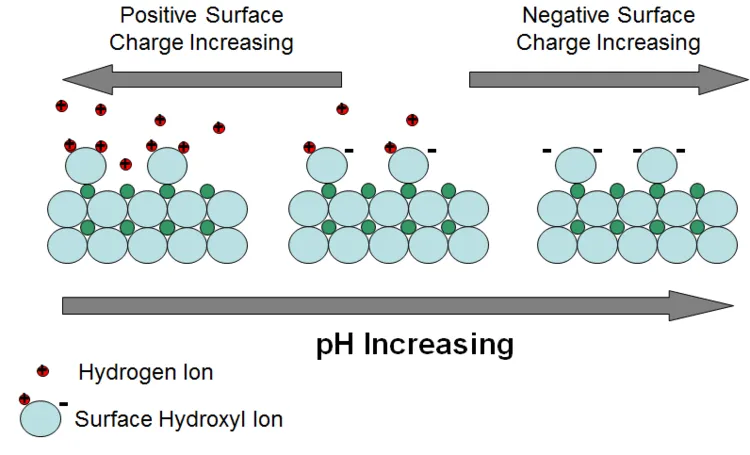
▲ 图2. 不同pH的矿物表面交换氢离子
吸附机理理论考虑的是离子被吸引到矿物表面的结构。一般来说,有离子接触到矿物表面是因为它们失去了部分或全部的溶剂化水。也有一些离子保留了它们的溶剂化水,存在于一个扩散层中,随着距离矿物表面的距离,携带的电荷更少。接触矿物表面的吸附离子与表面的结合更强。这种类型的吸附在各种研究中被称为球内吸附或络合,特定吸附或化学吸附。离子在扩散层中保留其溶剂化水的吸附称为外球吸附或络合、非特异性吸附或物理吸附。
离子交换可视为一种吸附,但其定义在文献中有所不同。某些矿物,如蒙脱石粘土和沸石,在它们的晶体结构和地下水之间交换阳离子,而有些矿物交换阴离子。离子也在外球络合物层和地下水界面离子扩散层交换。广义地说,离子交换包括离子在矿物表面和水相之间交换的所有情况。在土壤科学中,有时会使用一种更严格的离子交换定义,即只包括“易交换”的离子作为外层球体络合物或在扩散层中。为了保持地下水中的电中性,交换电荷的摩尔数必须相等。这可能意味着:1)在化学计量中具有相同电荷的离子交换导致地下水中净电荷变化为零,或2)在化学计量中阳离子和阴离子交换导致地下水中净电荷变化为零。
含水层固体交换阳离子或阴离子的能力可以用标准化的方法来测定。这些是含水层是否能够容纳污染物金属的充分吸附的良好指标。然而,必须记住,测量是在一组特定的条件下进行的。在受污染的含水层条件下,吸附量可少可多。阳离子交换容量对几种金属迁移性的影响被纳入评估无机物MNA的情景系统中。
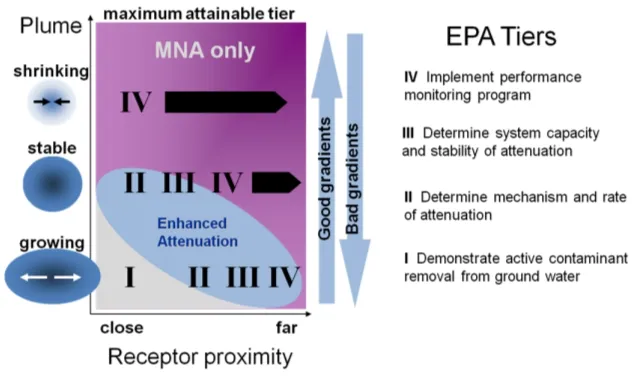
▲ 根据污染羽行为和受体接近度绘制的实施MNA的分层方法示意图
沉淀
污染物金属的沉淀是一种有效的衰减机制。沉淀与吸附的不同之处在于污染物被结合在矿物的三维结构或矿物的无定形前身中。这种矿物可以由污染物与地下水中的反离子结合而成。例如,铅可以与硫酸盐离子结合,通过反应形成矿物铅矾(PbSO4):
Pb+2 + SO4-2 = PbSO4
该反应的平衡常数,通常称为溶解度积Ksp ,定义为:
Ksp = aPb+2 X aSO4-2
其中ai 为物质i的活性或有效浓度。当aPb+2 和aSO4-2的乘积等于Ksp 时,地下水被称为铅矾饱和。如果乘积超过Ksp,那么从热力学上讲有利于铅矾的沉淀。注意,Ksp专门指的是Pb+2 离子和SO4-2离子。其他溶解物质如PbCl2o, PbCO3o, 甚至 PbSO4o中的铅不被考虑在内。因此,金属在水中的形态对于控制它是否会从地下水中沉淀是很重要的。对地下水中铅和硫酸盐浓度的检测提供了可能分布在许多种类中的每种成分的总溶解浓度。大多数水地球化学教科书都讨论了含水层中矿物质的沉淀。
有几种特殊的沉淀情况。一种是共沉淀,即污染物是沉淀矿物的少量成分。金属可以在矿物中共沉淀,要么是因为它在化学上类似于矿物的主要成分,要么是因为它在沉淀发生时吸附在矿物表面,在矿物继续沉淀时被“困住”。另一种是表面沉淀,即一种矿物在另一种矿物表面的成核和沉淀。在这种情况下,组成沉淀矿物的离子的吸附使相关离子的活性变得足够高,以至于宿主矿物表面的水层被沉淀矿物饱和。沉淀矿物在寄主矿物表面可能是饱和的,但在整体地下水中可能是不饱和的。
微生物反应也可以通过使金属和类金属从地下水中沉淀而影响金属和类金属的迁移性。在强还原条件下,微生物催化硫酸盐还原为硫化物。锌(Zn)、铅(Pb)、镍(Ni)、镉(Cd)等金属以及对氧化还原敏感的砷(as)、铜(Cu)、汞(Hg)很容易以硫化物矿物的形式沉淀。这种还原条件通常是由一系列微生物反应引起的,这些反应消耗了系统中的氧化剂,如氧气、硝酸盐、铁。对于其他金属,如铬(Cr)和铀(U),微生物引起的还原条件将氧化和迁移形态(Cr(VI)和U(VI))转变为还原形态(Cr(III)和(UIV)),以氢氧化物或氧化物的形态沉淀。
胶体迁移
污染物可以通过胶体颗粒在地下水中迁移,这可以增强金属和类金属的迁移性。当污染物附着在矿物的可迁移的胶体颗粒上,或者当污染物从地下水中沉淀下来,但仍以胶体颗粒的形式保持可迁移时,就会发生这种情况。胶体颗粒的迁移性取决于颗粒之间的表面电荷以及相对于含水层矿物表面的电荷。它们对pH值和离子强度最敏感。尽管与胶体颗粒相关的污染物广泛存在,但胶体颗粒携带的污染物浓度并不是接触点超过监管标准的主要原因。
指标因素
地下水专业人员评估几种金属和无机物的迁移性,需要关注三个主要因素(氧化/还原电位(ORP);阳离子交换容量(CEC)、沉积物氧化铁涂层和固体),并结合三个次要因素(pH、硫/硫化物、总溶解固体),以提供半定性的迁移性指标。
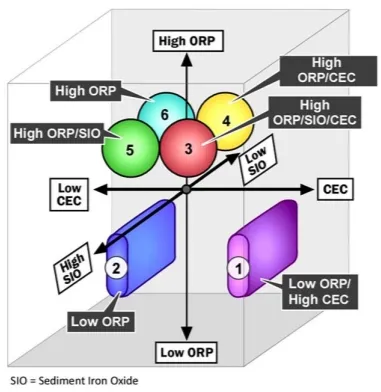
▲ 重要指标的三维图
(编译于迈尔斯.德纳姆博士的相关文章)